2-8 이상기체의 열역학
이상기체의 열역학 <매우중요(Very Important)>
공기압축기에서 이상기체 열역학적 상태 변화는 크게 보면 모든 부분에서 모두 이루어진다. 그러나 이걸 계산하기는 쉽지 않다. 그래서 이해를 하려면 개별적으로 분석하여 전체적인 개념을 이해해야 한다. 반드시 이해하고 넘어가야 한다.
(1) 이상기체의 열역학적 상태 변화 : 이상기체의 열역학적인 상태 변화란 어느 이상기체의 온도, 압력, 부피 등의 물리량 이 변화되는 과정을 의미한다.
초기 열역학적 상태에서 나중 열역학적 상태로의 변화 열역학적 상태 : 압력, 부피, 온도가 일정하게 유지되는 하나의 상태로 이상 기체의 열역학적 상태는 이상 기체 상태 방정식을 통해 압력, 부피, 온도 중 두 가지 물리량만 결정되면 나머지 열역학 함수들을 계산할 수 있다. 온도, 압력, 부피가 모두 변하는 과정은 복잡한 수학 지식이 수반되어야 하므로 우선한 가지 물리량은 고정하고 나머지 두 가지 물리량의 변화에 따른 과정을 정리한다.
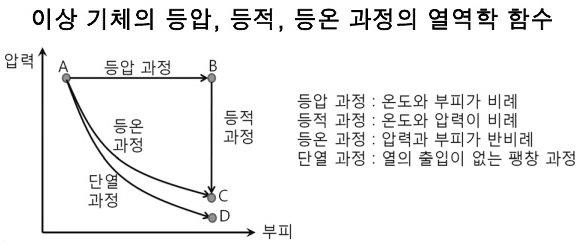
(2) 가역 등압 과정
① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.

(3) 가역 등적 과정
① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.
(4) 가역 등온 과정
① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다. 온도변화가 없다면 운동에너지 변화가 없으므로 등온 과정에서는 내부 에너지 변화가 없다.

(5) 가역 단열 과정
① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.

가역변화(reversible change) – 엔트로피 변화의 총합이 0(zero)인 변화
비-가역적인 변화가 아닌 변화 즉, 어떤 변화에서 하나의 시스템이 열역학적 상태 S1로부터 시작해서 상태 S2에 도달케 한 다음, 다시 상태 S1로 복귀시키는 경우에, 사용할지도 모르는 다른 물체도 사용 전의 역학적 상태로 복귀시킬 수 있을 때, S1에서 S2로의 변화를 가역변화라고 한다.
예를 들면 마찰이 없는 진공 속에서 운동하는 진자는 운동에너지와 위치에너지가 상호 전환하여 주기적으로 원상태로 복귀한다. 이와 같은 변화 즉, 하나의 역학적 상태에서 다른 역학적 상태로의 변화를 반복할 수 있는 경우를 가역변화라 한다.
비-가역변화(irreversible change) – 엔트로피 변화의 총합이 증가
물체에 어떤 변화를 가한 다음, 그 상태를 다시 변화 전의 원래의 상태로 복귀시키는 경우, 이때 물체 자신이 다시 원래의 상태로 복귀하면서 다른 어떤 변화를 주위에 남길 경우를 비-가역변화라 한다. (가능한 모든 방법을 사용해도)
예를 들면 고온물체와 저온물체를 서로 접촉하면 언젠가는 서로 온도가 같아지게 된다. 그러나 이들을 다시 원래의 온도로 복귀시키고자 할 경우, 고온물체는 가열해야 하고, 저온물체는 냉각시켜야 한다. 가열 또는 냉각시키기 위해서는 별도의 장치를 필요로 하며, 또 주위의 대기 등에 어떤 변화를 남기게 된다.
엔탈피(enthalpy)
열역학적 상태를 표시하는 물리량의 하나. 물체 내부 에너지와 밖에서 가해진 압력으로 인한 부피 변화량을 합한 것, 즉 H=U+pV(U는 내부 에너지, p는 압력, V는 부피)로 정의된다.
엔트로피(entropy)
열역학에서 중요한 제1법칙은 에너지보존의 법칙, 즉 우주에 존재하는 에너지 총량은 일정하며 절대 변하지 않는다는 것이다. 제2법칙은 대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 이미 진행된 변화를 되돌릴 수 없다는 의미이다. 따라서 자연 물질계의 변화는 엔트로피의 총량이 증가하는 방향으로 진행한다. 이것을 엔트로피 증가의 법칙이라고 한다. 즉 가용할 수 있는 에너지는 일정한데 자연의 물질은 일정한 방향으로만 움직이기 때문에 무용한 상태로 변화한 자연현상이나 물질의 변화는 다시 되돌릴 수 없다는 것이다. 즉 다시 가용할 수 있는 상태로 환원시킬 수 없는, 무용의 상태로 전환된 질량(에너지)의 총량을 ‘엔트로피(entropy)’고 한다.

